2021年硕士研究生招生考试试题
科目代码及名称: 620分析化学
适用专业(方向):070300化学
请考生按规定用笔将所有试题的答案写在答题纸上,在此试题纸上答题无效
一、选择题(共17小题,每小题2分,共34分)
1、关于准确度与精密度关系的四种表述中正确的是( )
(1)精密度是保证准确度的必要条件
(2)高的精密度一定能保证高的准确度
(3)精密度差,所测结果不可靠,再衡量准确度没有意义
(4)只要准确度高,不必考虑精密度
A、1.3 B、2.4 C、1.4 D、2.3
2、二乙三氨五乙酸( ETPA, 用HL表示)的pKa1~pKa5分别是1.94、2.87、4.37、8.69和10.56, 溶液中的H3L2-组分浓度最大时的pH是( )
A、 2.87 B、 3.62 C、 5.00 D、 9.62
3、含有相同浓度MgY2-的pH = 10.0的氨性缓冲溶液A、B两份。A溶液中含有0.2 mol·L-1游离氨,B溶液中含有0.1 mol·L-1游离氨。指出下列叙述中错误的结论( )
A、AB两溶液中K’MgY相等 B、AB两溶液的lgαY(H)相等
C、AB两溶液中的[Mg2+]相等 D、AB两溶液中的[Y]不相等
4、络合滴定中,指示剂的封闭现象是由( )引起的。
A、指示剂与金属离子生成的络合物不稳定
B、被测溶液的酸度过高
C、指示剂与金属离子生成的络合物稳定性小于MY的稳定性
D、指示剂与金属离子生成的络合物稳定性大于MY的稳定性
5、已知E0’(Fe3+/Fe2+)=0.68 V,E0’(Sn4+/Sn2+)=0.14 V,用Fe3+滴定Sn2+在化学计量点的电位是( )
A、 0.75 V B、0.68 V C、0.41 V D、 0.32 V
6、以下有关化学需氧量COD说法错误的是( )
A、COD是表征水体质量的一项重要指标。
B、COD可以表征水体受无机物污染的程度。
C、COD测定可以采用KMnO4法或K2Cr2O7法。
D、KMnO4法测污染严重水样COD时,必须考虑Cl-的干扰影响。
7、间接碘量法中加入淀粉指示剂的适宜时间是( )
A、滴定开始前 B、滴定开始后
C、滴定至接近终点 D、滴定至红棕色褪尽至无色
8、莫尔法测定Cl-含量时,要求介质的pH在6.5~10范围内,若酸度过高则 ( )
A、AgCl沉淀不完全 B、AgCl吸附Cl-增强
C、Ag2CrO4沉淀不易形成 D、AgCl沉淀易胶溶
9、用BaSO4重量法测定Ba2+含量,若结果偏低,可能是由于( )
A、沉淀中含有Fe3+等杂质 B、沉淀中包藏了BaCl2
C、沉淀剂H2SO4在灼烧时挥发 D、 沉淀灼烧的时间不足
10、在紫外-可见分光光度法测定中,使用参比溶液的作用是( )
A、调节仪器透光率的零点 B、吸收入射光中测定所需要的光波
C、调节入射光的光强度 D、消除试剂等非测定物质对入射光吸收的影响
11、用电位滴定法测定水样中的Cl-浓度时,可以选用的指示电极为( )
A、Pt电极 B、Au电极 C、Ag电极 D、Zn电极
12、阳极溶出伏安法的灵敏度高的主要原因在于( )
A、预电解 B、溶液的搅拌 C、使用悬汞电极 D、检测器灵敏度高
13、一价离子选择电极的研究特别受到重视,主要是因为( )
A、灵敏度高 B、选择性好 C、受pH影响小 D、测量误差小
14、由原子外层电子跃迁产生的光谱是下列哪一种?( )
A、带状光谱 B、线光谱 C、连续光谱 D、X射线光谱
15、目前原子吸收光谱仪采用的光源是( )
A、氙灯 B、ICP C、钨灯 D、空心阴极灯
16、对于原子荧光来说,下列哪种说法是正确的?( )
A、原子荧光属于吸收光谱
B、原子荧光属于发射光谱
C、原子荧光的应用范围与原子吸收差不多
D、原子荧光的原子化器与原子吸收完全不一样
17、紫外光谱中,随着有机物的共轭链加长,最大吸收波长max( )
A、 红移 B、紫移 C、不变 D、都有可能
二、填空题 (共8小题,共20分)
1、(2分)系统误差产生的原因________、__________、_________、___________。
2、(2分)NH4H2PO4 溶液的质子条件是_____________________________
3、(5分) 在pH=5.5的醋酸缓冲液中,用0.020 mol·L-1的EDTA滴定同浓度的Zn2+,
已知: lgKZnY =16.5,lgαY(H)=5.5。则化学计量点时,pZn=_______; pZnY=________;pY=________;pY'=________; lgK'ZnY =________。
4、(2分)已知E0(IO3-/I2)= 1.20 V,E0(I2/I-)= 0.535 V, 则反应的平衡常数为________________________。
5、(2分)有一由碱金属氯化物和铬酸盐所组成的混合物,填表说明如何利用佛尔哈德法测定其中的氯化物:
滴定方式 | 所用标准溶液 | 指示剂 | 酸碱度 |
6、(4分)比较下列各组物质溶解度的大小(用 >, < ,=符号表式)。
(1) AgCl(在纯水中) ______ AgCl(在0.1 mol·L-1 NH4Cl中)
(2) AgCl(在2 mol·L-1 NaCl中) ______AgCl(在纯水中)
(3) AgCl(在0.01 mol·L-1 NaCl中) ______ AgCl(在2 mol·L-1 HCl中)
(4) Ag2CrO4(在0.001 mol·L-1 AgNO3中)______ Ag2CrO4(在0.001 mol·L-1 K2CrO4中)
已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10,Ag+与Cl-生成络合物,lgβ1=3.0, lgβ2=5.0
7、(1分)吸光光度分析中,为减少测量误差,吸光度A范围应控制在_____________________或透光率T范围______________________。
8、(2分)分光光度计的基本构成部件为:________________________。
三、判断题(共6小题, 对的打“∨”,错的打“×”,每小题1分,共6分)
1、分析混合烷烃试样时,可选择极性固定相,按沸点大小顺序出峰。( )
2、某试样的色彩谱图上出现三个色谱峰,该试样中最多有三个组分。( )
3、根据速率理论,毛细管色谱高柱效的原因之一是由于涡流扩散项A=0。( )
4、FID检测器对所有的化合物均有响应,故属于广谱型检测器。( )
5、速率理论给出了影响柱效的因素及提高柱效的途径。( )
6、正相分配色谱的流动相极性大于固定相极性。( )
四、计算题(共3小题,共32分)
1、(12分)请写出Ag+/Ag电对的电极反应式及能斯特公式,并求出pH=9.26时,0.2mol·L-1 NH4NO3体系中Ag+/Ag电对的条件电势。已知:E0(Ag+/Ag)=0.80V,NH4+的pKa=9.26,Ag(NH3)2+的lgβ1=3.2、lgβ2=7.0。
2、(11分)用邻二氮菲吸光光度法测定某发黄浓盐酸中Fe含量。先吸取浓盐酸原液2.00mL稀释并定容在50mL容量瓶中,再吸取其中5.00mL经预还原处理后以邻二氮菲显色并定容于50mL。同时配制Fe标准显色系列。选用1cm比色皿,以试剂空白为参比,在510nm波长下测得Fe标准系列与待测试液的吸光度数据如下:
Fe (µg·mL-1) 0.00 0.50 1.00 1.50 2.00 Cx
A 0.000 0.101 0.205 0.302 0.407 0.136
求:(1)工作曲线;(2)摩尔吸光系数ε;(3)浓盐酸原液中Fe的含量(µg·mL-1)。
已知MFe=55.85 g·mol-1
3、(9分)测定一铁矿中铁的含量(%),数据如下:20.18、20.35、20.22、20.17、20.13、20.26。试用格鲁布斯法判断,是否有可疑值应舍去?正确报出平均结果,标准偏差和平均值的置信区间。
Tα,n值表:
n 3 4 5 6 7 8 9 10
T0.05,n 1.15 1.46 1.67 1.82 1.94 2.03 2.11 2.18
tα,f值表:
f 3 4 5 6 7 8 9 10
t0.05,f 3.18 2.78 2.57 2.45 2.36 2.31 2.26 2.23
五、简答题(共8小题,第1小题5分,第2小题4分;第3-5小题,每小题3分; 第6-8小题,每小题4分,共30分)
1、(5分)在3mol·L-1盐酸中,铜的半波电位为0V左右,铅的半波电位为-0.46V,镉的半波电位为-0.70V,而锌在-0.90V以后才还原,试分别讨论下述两种极谱分析有无干扰,为什么?
(1)测定纯锌试样中微量的铅和镉; (2)大量铜存在下测定铅和镉。
2、(4分)用离子选择电极以标准加入法进行定量分析时,对加入的标准溶液又什么要求?为什么?
3、(3分)简述氢火焰离子化检测器的基本结构和工作原理。
4、(3分)为什么毛细管色谱系统要采用分流进样和尾吹装置?
5、(3分)以FID为检测器时,为什么用甲烷求死时间而不用空气?
6、(4分)请简述原子发射光谱和原子吸收光谱的异同点(原理、仪器、应用)。
7、(4分)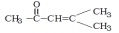 的紫外-可见吸收光谱有哪两种主要吸收带?其特征是什么?这些吸收带分别由何种电子跃迁产生?
的紫外-可见吸收光谱有哪两种主要吸收带?其特征是什么?这些吸收带分别由何种电子跃迁产生?
8、(4分)校园里的银杏是一道美丽的风景线,若对银杏叶中微量金属元素组成情况进行考察,采用原子发射光谱进行定性分析,试简述其方法的定性依据及基本分析过程。
六、设计题(共2小题,第1小题12分,第2小题16分,共28分)
1、(12分)设计测定含有中性杂质的Na2CO3与Na3PO4混合物中二组分质量分数的分析方案。用简单流程表明主要步骤、滴定剂、指示剂、结果计算公式。(酸碱滴定法)。
已知Na3PO4:pKb1=10-1.64 ,pKb2=10-6.80,pKb3=10-11.88
2、(16分)某锌试液中含有少量Fe3+和Ca2+,预用EDTA滴定法测定其中Zn2+的含量,试以络合滴定法设计一合理的分析方案,并写出相应计算公式(结果用g·L-1表示)。请按如下提示作答:
(1)给出准确滴定与分别滴定的判据,并分析滴定的可行性;
(2)计算确定滴定Zn2+的适宜酸度,选择合适缓冲体系;
(3)选择合适指示剂与干扰消除方法,确定具体分析方案;滴定终点误差计算公式?
(4)报出结果计算公式。
已知:lgKZnY =16.5、lgKFeY=25.1、lgKCaY=10.7、pKspZn(OH)2=16.9,HAc的pKa=4.76; (CH2)6N4H+的pKa=5.15;NH4+的pKa=9.26;
常用Fe3+配位掩蔽剂: pH 9~10 三乙醇胺 pH 5~6 乙酰丙酮 pH 3~4 NH4HF2
pH | 3 | 3.5 | 4 | 4.5 | 5 | 5.5 | 6 | 6.5 | 7 | 7.5 | 8 | 8.5 | 9 |
lgαY(H) | 10.6 | 9.5 | 8.4 | 7.4 | 6.5 | 5.5 | 4.7 | 3.9 | 3.3 | 2.8 | 2.3 | 1.8 | 1.3 |
相关推荐:
扫一扫二维码,加入考研微信群
超多干货福利随机掉落,志同道合小伙伴随时交流~ | 扫一扫二维码,关注233考研微信公众号
最新资讯第一时间知晓,备考经验技巧专栏传授 |











