【2021上半年教资面试真题及答案汇总>>】【在线真题库>>】
2021上半年高中化学教师资格证面试考试已结束,233网校更新了本次考试真题及答案,供各位考生参考!

1题目:二氧化硅
2.内容:
SiO2是硅最重要的化合物。地球上存在的天然二氧化硅约占地壳质里的12%,其存在形态有结晶形和无定形两大类,统称硅石。
石英晶体是结晶的1氧化硅 ,具有不同的晶型和色彩 。石英中无色透明的晶体就是通常所说的水晶,具有色彩环带状或层状的称为玛瑙。沙子中含有小粒的石英晶体。
SiO2的网状结构决定了它具有优良的物理和化学性质,加上SiO2在自然界的广泛存在,从古到今都被人类广泛地应用着。例如,以SiO2为主要成分的沙子仍然是基本的建筑材料,纯净的SiO2是现代光学及光纤制品的基本原料,用石英、玛瑙制作的饰物和工艺品则为越来越多的人们所喜爱。
思考交流
根据SiO2的存在和应用;请你分析以下问题: SiO2具有哪些物理性质?化学稳定性如何?你的根据是什么? SiO2的这些性质是由什么决定的?将你的认识写在下面横线上,并与同学交流。
物理性质:
化学稳定性:
SiO2的化学性质很不活泼,氢氟酸(HF) 是惟一可以与之发生反应的酸:
SiO2+4HF- =SF4↑+2H2O
玻璃中含有SiO2,所以可以用HF来刻蚀玻璃。
SiO2是酸性氧化物,它可能发生哪些化学反应? SiO2与碱性氧化物反应生成盐,例如:
SiO:+CaO====CaSiO3
SiO2与强碱反应生成盐,例如:
SiO2+2N2OH====Na2SiO3+H2O
3基本要求:
(1)试讲时间10分钟。
(2)教学过程中要有师生互动、课堂提问。
(3)要求配合教学内容有适当板书设计。
参考解析:
[教学过程]
一:情景引入
教师提问:同学们,大家知道我们日常生活中见到的岩石和沙子属于什么状态的物质吗?主要成分是什么?
学生回答:岩石和沙子是固态的物质,硬度很大。
教师总结:对,岩石和沙子非常坚硬,因为它的主要成分是二氧化硅,这节课就一起来探究“二氧化硅”的性质。
二:新课教学
[复习回顾]二氧化硅与二氧化碳都是IVA族元素形成的最高价氧化物,它们的性质是否相同呢?回忆初中学过的二氧化碳的性质,并从物理性质和化学性质两方面回答。
学生回答:①二氧化碳的物理性质:常温常压下是无色无味的气体,能溶于水,密度比空气大;
②能与水反应生成碳酸,能与碱反应,是酸性氧化物。
[媒体展示]观看视频上展示的多种含二氧化硅的物质,比较二氧化碳和二氧化硅的物理性质。
学生回答:二氧化硅与二氧化碳的物理性质差别很大,它是一-种坚硬难熔的固体,不溶于水。
教师提问:二氧化硅有哪些应用?
学生回答:①以SiO2为主要成分的沙子是基本的建筑材料;
②用石英、玛瑙可以制作各种饰物和工艺品。
[教师补充]纯净的SiO2是现在光学及光纤制品的基本原料。
[视频展示]二氧化硅和-氧化碳都是酸性氧化物,那么它们的化学性质是否相同呢,观看视频演示的二氧化硅分别与盐酸、硫酸、氢氟酸反应的视频,描述现象,并书写化学方程式?
学生回答:二氧化硅与盐酸、硫酸不反应,与氢氟酸能够发生反应,
SiO2+4HF==SiF4↑+2H2O。
[教师讲解]与CO2不同,SiO2的化学性质很不活泼,氢氟酸是惟一可以与之发生反应的酸。SiO2 可以与碱性氧化物、碱反应,类比二氧化碳的方程式书写方法,尝试写出SiO2与氧化钙、氢氧化钠反应的化学方程式。
[学生回答] SiO2+CaO===CaSiO3、SiO+2NaOH== Na2SiO3+H2O。
三:拓展提高
[教师引导]己知二氧化硅的物理性质和化学性质,可以利用这些知识解决日常生活中的很多问题。接下来分小组讨论如下两个问题:
①为什么实验室中盛放碱液的试剂瓶用橡皮塞而不用玻璃塞?
②氢氟酸能否储存在玻璃试剂瓶中,你有什么启示?
[合作探究]
①因为玻璃中含有SiO2, SiO2 是酸性氧化物,能和碱起反应,容易使玻璃瓶塞和瓶颈粘在一起而不能打开。
②二氧化硅与氢氟酸能够发生反应,故不能用玻璃试剂瓶盛装氢氟酸,可以用塑料制品或铅器皿储存,我们可以用氢氟酸雕刻玻璃。
四:小结作业
小结:这节课我们学习了二氧化硅及其物理性质和化学性质,了解了二氧化硅是一种及其坚硬的固体,不溶于水,希望同学们能够将课堂所学应用到今后的学习和生活中。
作业:思考元素的金属性和非金属性的递变规律如何?
板书设计:略
1.题目:高一《硅的性质》片段教学
2.内容:硅的性质
3.基本要求:
(1)试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、问题导入,激发情感
1.教师展示新兴职业,提问:同学们对哪些新兴职业更感兴趣呢?
2.教师提出问题:你知道计算机中最重要的是什么吗?今天我们就来学习一下计算机中芯片中的重要元素一硅。
二、自主探究,讲授新课
1.教师提出问题,请同学们从元素周期律的角度来推测一下硅单质有哪些性质?
2.学生根据硅元素在元素周期表中的位置关系,推测出硅为过渡元素,可以初步推测硅单质的相关性质。
3.教师展示硅单质,请学生观察并总结硅单质的相关的物理性质,教师对学生的总结进行补充,完善硅单质的物理性质。
4.教师请学生通过阅读资料的方式了解硅在自然界中的存在方式及用途。
5.教师提出问题,如何将自然界中的二氧化硅转化为可利用的高纯硅呢?学生分组合作并进行合理猜测。
6.教师请学生观看高纯硅的制备视频,并请学生结合资料卡片,组内讨论硅的制取原理。北同现心
7.学生通过视频,组内讨论得出二氧化硅转化为单质硅的原理。
8.教师播放硅单质的应用视频,请学生总结单质硅的用途。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下查阅资料,以“你不了解的硅”为主题,写一篇科普文章。
六、板书设计:略
1.题目:高一《卤素单质与氢气反应》片段教学
2:内容:

3.基本要求:
试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、问题导入,激发情感
1.教师出示多瓶不同颜色的气体,请同学们利用所学知识猜测是哪些气体?
2.学生利用卤素单质的性质这一知识点,快速判断出气体。
3.教师提出问题:卤素单质有哪些化学性质呢?引入课题。
二、实验探究,讲授新课
1.教师请学生从氧化还原的角度推测卤素单质的性质。学生初步预测卤素单质的性质。
2.教师对学生的预测进行点评,并介绍卤素单质可以与氢气反应这一特性。师
3.教师请学生从原子结构的角度推测不同卤素单质与卤素单质反应的难易程度。
4.教师请学生观察卤素单质与氢气反应的实验视频,请学生根据视频判断自己的预测是否准确。
5.学生总结卤素单质与氢气反应过程中的现象,并用表格的形式进行汇总。教师进一步提出问题:请回忆卤素单质与氢气的反应,尝试总结生成的氢化物的稳定性。
6.学生通过对视频的回顾,组内讨论, 总结出生成氢化物的稳定性。
7.教师请学生对上述反应进行分析,总结出卤素单质非金属性的强弱变化。
8.教师提出问题:请同学们观察以上的递变性,尝试总结卤素单质与氢气反应中的递变性。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深
四、归纳总结,深入理解
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下查阅资料,了解卤素单质之间的反应。
板书设计:略
1题目,高一《铁的氧化物》片段教学
2.内容:

3.基本要求
(1)试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、问题导入,激发情感
1教师展示我国金属使用分布图,提出问题:我国使用最多的金属是什么呢?我国金属浪费最多的是哪种金属呢?
2.学生通过对图片的观察得出使用最多的金属是铁,同时通过日常生活中金属的浪费现象得出浪费最严重的的金属是铁。
3.教师提出问题:铁的浪费大部分是由于氧化,铁有哪些氧化物呢?
二、实验探究,讲授新课
1.教师请学生根据铁元素的化合价猜测铁的氧化物的种类。
2.教师展示氧化铁,氧化亚铁,四氧化三铁。请学生观察铁的三种氧化物的物理性质,并分析对应氧化物中铁的化合价。
3.教师补充介绍铁的三种氧化物物理性质并介绍其在日常生活中的应用。
4:教师请学生通过铁的氧化物的物理性质总结三种氧化物的鉴别方式。学生总结出可以通过颜色及氧化性对三种氧化物进行鉴别。
5.教师请学生预测铁的氧化物的化学性质。学生根据金属氧化物与酸反应的特性,推断三种物质都能与酸反应。
6.教师请学生进行分组实验,验证铁的氧化物与盐酸反应的反应原理。
7.学生动手实验,并总结实验现象及反应原理。
8.教师请学生以表格的形式汇总铁的氧化物的物理性质与化学性质。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解国教师
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下查阅资料,了解铁相关合金的知识。
板书设计:略
1.题目: 高中《氯气与水反应》片段教学
2.内容:

3.基本要求:
(1)试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一。多媒体导入,激发情感
1.多媒体播放净水厂用氯气对自来水进行杀菌消毒的视频,提出问题:氯气净水的原理是哪些呢?
二、实验探究,讲授新课
1.教师展示氯气溶于水的资料卡片,提出问题:氯气的溶解度如何?学生总结出1体积水可溶解约2体积的氯气。
2.教师演示氯气溶于水的实验,并介绍氯水溶于水之后形成的溶液为氯水。
3.教师提出问题:氯水有哪些性质呢?请学生进行猜测。
4.学生预测氯水显酸性,猜测氯气与水反应形成盐酸。教师请学生从化合价的角度分析,预测可能会生成次氯酸。教师对学生的预测进行肯定。
5.教师进- -步提出问题:为什么是氯气溶于水可以杀菌消毒呢?
6.学生通过分析总结出可能是由于次氯酸具有氧化性,可以杀菌消毒。
7.教师介绍国家对于氯气净水的相关规定。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下查阅资料,了解次氯酸的其他应用。
板书设计:
氯气与水反应
1.Cl2+H2O=HCI+HCIO
2.次氯酸具有氧化性,可以杀菌消毒
1.题目:高一《胶体的丁达尔效应》片段教学
2.内容:

3.基本要求:
(1).试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、问题导入,激发情感
1.教师提出问题:同学们我们生活中常见的胶体有哪些呢?学生梳理常见的胶体并回答问题。
2.教师展示清晨树林中的于达尔效应图片,提出问题:雾是胶体的一种,为什么雾会出现图片中的现象呢?
二、实验探究,讲授新课
1.教师请同学们分组利用硫酸铜溶液制备氢氧化铜胶体。
2.学生设计胶体制备实验,并分组进行胶体的制备。教师巡视学生实验,并对学生的实验进行点评。
3.教师让学生利用红色激光笔在阴暗的环境下照射硫酸铜溶液和氢氧化铜胶体,观察并记录实验现象。
4.教师请学生分别汇报实验现象,总结出激光笔照射胶体会出现红色的光亮的“通路”, 溶液不会出现这一结论。
5.教师请学生进一步通过不同的胶体与溶液进一步验证这一结论。
6.教师介绍于达尔效应。并提出问题:为什么会出现丁达尔效应呢?
7.学生分组讨论得出出现于达尔效应的原因可能与胶体粒子的直径有关。
8.教师播放丁达尔效应的短视频,请同学们观看视频,总结出丁达尔效应的原因是由于胶体粒子对光的散射形成的。
9、教师介绍丁达尔效应的发现史,带领学生进一步认识认识
10.教师提出问题:如何鉴别溶液与胶体呢?学生总结出丁达.尔效应可以有效地鉴别溶液与胶体。
11.教师提出问题:生活中还有哪些J达尔效应呢?请学生们分组讨论并总结。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解.
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,
并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下查阅资料,了解胶体有哪些应用,并书写一篇科普短文。
板书设计:
饱和溶液
1.胶体的丁达尔效应:胶体粒子对光的散射形成的。
2.溶液与胶体鉴别:丁达尔效应
1.题目:高一《硫酸与硝酸的氧化性》片段教学
2.内容:

3.基本要求:
(1)试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、问题导入,激发情感
1.教师提出问题:硫酸和硝酸都具有酸的通性,具体有哪些?
2.学生总结酸的通性,教师进一步提出问题:实验室里用金属和酸的反应制取氢气时,往往用稀硫酸或盐酸,而不用浓硫酸或硝酸,这是为什么?
二、实验探究,讲授新课
1,教师通过播放视频引导学生回顾浓硫酸的吸水性与脱水性。
2.教师提出问题:在浓硫酸的脱水性实验中,产生的具有刺激性气体是什么呢?学生根据元素守恒及二氧化硫的性质,推测生成的气体为二氧化硫。
3.如果生成的气体为二氧化硫,体现硫酸的哪些特性呢?学生通过元素化合价的变化,推测浓硫酸可能具有强氧化性。
4.教师演示铜与浓硫酸加热的反应,请学生观察实验现象,
5.学生通过对实验的观察总结出浓硫酸具有氧化性,可以与
铜生成二氧化硫,进一步确定浓硫酸具有氧化性的猜测。
6.教师进一步 解释浓硫酸与蔗糖反应过程中生成二氧化硫的原理。
7,浓硫酸不能和活泼金属制取氢气时因为它的强氧化性,硝酸是否具有一样的性质呢? a 教师
8.学生观看浓硝酸与稀硝酸分别与铜反应的视频实验,组内谈论。
9.学生通过讨论总结出浓硝酸与稀硝酸都具有氧化性,可以与铜反应生成氮的氧化物。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下查阅资料,了 解浓硫酸与浓硝酸的应用。
板书设计:略
1.题目:高一《元素周期表》片段教学
2.内容:

3.基本要求:
(1)试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、故事导入,激发情感
1:教师用多媒体出示门捷列夫的图片,并讲述门捷列夫发现元素周期表的故事,引入新课,激发兴趣。
二、问题探究,讲授新课
1.教师请学生观察教材中的元素周期表,初步认识元素周期表的结构及其元素。
2,教师提出问题:元素周期表中有多少种元素?结构如何?
3.学生通过对教材的阅读,发现元素周期表中共112种元素,7横行,18纵行。
4.教师介绍周期、主族、副族、八族、零族的概念。并请同学们总结元素周期表中的周期数,主族数,副族数等。学生发现元素周期表包含:七个周期,七个主族,七个副族,一个八族,
一个零族。
5.教师进一步引导学生发现周期元素的种类。引导学生发现短周期、长周期和不完全周期。
6.教师请学生分组绘制不同周期中所有元素的核外电子排布,并发现其中的规律。
7.学生通过绘制同周期原子的核外电子排布总结出:周期数=核外电子层数这一-规律。
8.教师引导学生发现主族元素的原子之间的关系,学生总结得出:族序数=最外层电子数这一规律。
9.教师提出问题:元素周期表是如何排列的呢?学生通过对周期关系,族关系的分析得出结论。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下绘制前四周期元素的原子结构示意图,并尝试探究他们对化学性质的影响。
板书设计:
元素周期表
元素周期表:七个周期,七个主族,七个副族,-一个八族,一个零族
存在关系
周期数=核外电子层数
族序数=最外层电子数(主族)
1.题目:高一《铁合金》片段教学
2:内容:

3.基本要求:
(1)试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、问题导入,激发情感
1.教师提出问题:铁是我国使用最多的金属,但是铁比较活泼,极易氧化为氧化物,如何防止铁的氧化呢?
2.学生总结防止铁的氧化的措施包括:刷漆、涂油、电镀、制作合金等方式。
3:教师提问:对于铁的合金你了解哪些呢?引入课题。
二、问题探究,讲授新课
1.教师提出问题:什么是合金呢?铁有哪些合金呢?
2.学生通过阅读教材,总结出合金的概念,以及铁的合金包括生铁和钢。.
3.教师展示生铁和钢,并播放生铁和钢硬度,脆度,机械性能,延展性等方面的测试视频。请学生通过表格总结出相关的性能。
4教师播放钢中碳素钢的三种类型(低碳钢、中碳钢、高碳钢),并请学生观察三种钢的不同应用。
5.学生通过对视频的观看,总结出低碳钢、中碳钢、高碳钢的应用,并通过表格的方式进行对比分析。
6.教师介绍合金钢的组成、性能及相关应用,并请学生通过合金钢的性能预测合金钢的应用。
7.教师提出问题:生活中常见的铁的合金有哪些是呢?学生思考得出不锈钢也是铁的合金。
8.教师通过资料卡片的形式介绍不锈钢的组成及其相关性质等。
9.学生通过不锈钢的性质,自行推断出不锈钢的应用。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定,并做情感态度的升华。
五、紧扣主题,扩展延伸
请学生课下查阅资料,了解不同的合金,及其应用。
板书设计:略
1.题目:高一《蒸馏》片段教学
2.内容:

3.基本要求:
(1)试讲约10分钟;
(2)试讲过程中注意对于学生的引导;
(3)配合教学内容适当板书。
一、问题导入,激发情感
1.教师展示一杯无色透明的液体,提出问题:同学们,这杯液体可以饮用吗?
2.学生通过已有知识得知溶液中可能存在可溶杂质,不能直接饮用。
3.教师进一步提出问题:如何将这杯液体提纯呢?引入课题蒸馏
二、实验探究,讲授新课
1.教师提出问题:实验室我们可以用哪些方法进行分离与提纯呢?
2.学生总结出可以通过过滤、蒸发等操作进行提纯。
3.教师进一步提出问题:如果溶液为液体与液体的混合?那么可以利用哪些原理进行除杂呢?
4.学生分组讨论,得出结论:可以利用液体之间的沸点不同,进行除杂。
5.教师对学生的结论进行表扬,并介绍蒸馏操作的原理与实验仪器。
6.教师请学生根据实验装置,及实验原理总结实验过程中的注意事项(温度计的位置、冷凝管的使用、沸石的使用等)。
7.学生们分组进行蒸馏操作的实验。实验过程中教师进行巡视指导。
8.教师总结学生实验过程中出现的问题。并提出问题:蒸馏有哪些应用呢?
9.学生总结蒸馏的应用,并通过资料卡片的方式了解利用蒸馏进行海水淡化的原理。
三、习题拓展,巩固新知
通过多媒体的展示习题,将学生本节课学习到的知识进行深化。
四、归纳总结,深入理解
由学生总结本堂课的收获,教师对学生的课堂表现予以肯定。
五、紧扣主题,扩展延伸
请学生课下将所学过的净化方式进行对比,总结相关特点。
板书设计:略
1.题目:元素周期律
2.内容:
物质世界尽管丰富多彩、变化无穷,但一切物质都是由元素组成的。人类在长期的生产活动和科学实验中,逐渐认识了元素间的内在联系和元素性质变化的规律性,并以一定的方式将它们表示出来。
联想:质疑
目前已经发现的元素有110多种,在元素周期表中,元素是有序排列的。你是否想过元素为什么会按照这样的顺序在元素周期表中排列?它们之间存在着什么关系?人们是怎样描述这种关系的?
一、元素周期律
原子序数( atomic number)是元素在元素周期表中的序号,其数值等于原子核内的质子数或原子核外的电子数。研究原子序数为1-18的元素,可以帮助我们认识元素之间的内在联系和元素性质变化的规律性。
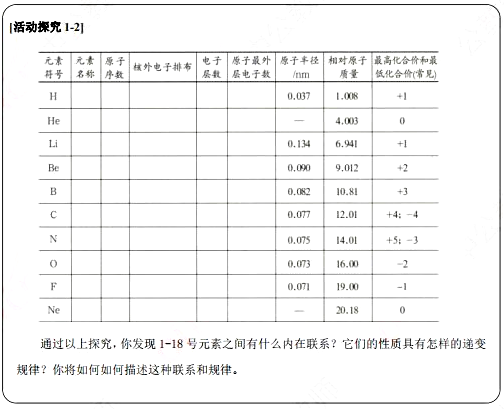
通过探究可以发现:随着原子序数的递增,元素原子的最外层电子排布、原子半径、元素的化合价等均呈现周期性变化。在大量科学研究的基础上,人们归纳出这样一条规律:元素的性质随着元素原子序数的递增呈周期性变化,这个规律叫做元素周期律.
3.基本要求:
(1)讲解元素周期律。
(2)体现探究性。
(3)有适当板书。
一、情景引入
多媒体给同学展示元素周期表的图片。
教师提问:我们都知道,在元素周期表中,元素是有序排列的。那元素为什么会按照这样的顺序排列?它们之间存在着什么关系?今天我们就一起来研究元素周期表的有关规律。
二、新课教学
提出问题:什么是原子序数?
学生回答:元素在元素周期表中的序号。
教师补充:其数值等于原子核内的质子数或原子核外的电子数。
活动探究:以小组为单位进行活动探究1-2。
教师引导:元素原子的最外层电子排布、原子半径、元素的化合价等方面进行探究,并探究到前18号元素。
提出问题:通过以上探究,发现元素之间有什么内在联系?它们的性质具有怎样的递变规律?你将如何描述这种联系和规律?
学生回答:随着原子序数的递增,元素原子的最外层电子排布、原子半径、元素的化合价等均呈现周期性变化。(1) 同一周期元素结构和性质具有一定的递变性,同周期电子层数不变,从左到右原子半径逐渐减小。
(2)同一主族元素结构和性质具有一定的相似性和递变性,同一主族从上到下电子层数依次增加原子半径逐渐增大。
提出问题:什么是元素周期律?
学生回答:元素的性质随着元素原子序数的递增呈周期性变化,这个规律叫做元素周期律。
三、拓展提高
提出问题:原子序号、核电荷数、质子数三者是等同的么?
学生回答:核电荷数和质子数是等同的,但是和原子序号有所区别,原子序号只是数值上与核电荷数、质子数相等,代表的意义不一样。
四、小结作业
小结:引导学生共同总结本节课的内容。
作业:思考元素的金属性和非金属性的递变规律如何?
五、板书设计:略
面试题库>>教师资格证面试题库免费刷(各科目)
考后关注>>2021上半年教师资格证面试成绩查询时间、入口
教师资格证面试如何快速通关?233网校还原面试情景现场,助你一举攻下“结构化面试+试讲+答辩”三大内容,实战通关!试听课程>>




