药品生产监督管理的含义: 是指(食品)药品监督管理部门依法对药品生产条件和生产过程进行审查、许可、监督检查等管理活动。
管理部门:国家食品药品监督管理局主管全国药品生产监督管理工作;省、自治区、直辖市(食品)药品监督管理部门负责本行政区域内的药品生产监督管理工作。
二、开办药品生产企业的申请与审批
1.开办条件:开办药品生产企业,除应当符合国家制定的药品行业发展规划和产业政策外,还应当符合以下条件:
(1)具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人,企业法定代表人或者企业负责人、质量负责人无《药品管理法》第七十六条规定的情形;
(2)具有与其药品生产相适应的厂房、设施和卫生环境;
(3)具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备;
(4)具有保证药品质量的规章制度。
2.申请人向省级FDA提交的材料
3.审批程序
4.新开办企业有关申请《药品生产质量管理规范》认证方面的规定新开办药品生产企业、药品生产企业新建药品生产车间或者新增生产剂型的,应当自取得药品生产证明文件或者经批准正式生产之日起30日内,按照国家食品药品监督管理局的规定向相应的(食品)药品监督管理部门申请《药品生产质量管理规范》认证。
三、药品生产许可证管理
1.《药品生产许可证》
2.《药品生产许可证》的变更
3.《药品生产许可证》的换发
四、药品委托生产的管理
1.药品委托生产双方的条件
委托方:应当是取得该药品批准文号的药品生产企业。
受托方:应当是持有与生产该药品的生产条件相适应的《药品生产质量管理规范》认证证书的药品生产企业。
2.药品委托生产双方的责任与合同
委托方:负责委托生产药品的质量和销售。委托 方应当对受托方的生产条件、生产技术 水平和质量管理状况进行详细考查,应
当向受托方提供委托生产药品的技术和 质量文件,对生产全过程进行指导和监督。
受托方:应当按照《药品生产质量管理规范》进行生产,并按照规定保存所有受托生产文 件和记录。
合同:委托生产药品的双方应当签署合同, 内容应当包括双方的权利与义务,并具体规定双方在药品委托生产技术、质量控制等方面的权利与义务,且应当符合国家有关药品管理的法律法规。
3.药品委托生产申请的受理和审批
(1)受理和审批的部门及其分工
SFDA:注射剂、生物制品(不含疫苗制品、血液制品)和跨省、自治区、直辖市 的药品委托生产。
省级FDA:以上规定之外的其他药品委托生产 申请,由委托生产双方所在地省、自 治区、直辖市(食品)药品监督管理 部门负责受理和审批。 特别说明: 疫苗制品、血液制品以及国家食品药品监督管理局规定的其他药品不得委托生产。麻醉药品、精神药品、医疗用毒性药品、放射性药品、药品类易制毒化学品的委托生产按照有关法律法规规定办理。
(2)委托生产申请、受理和审批的程序
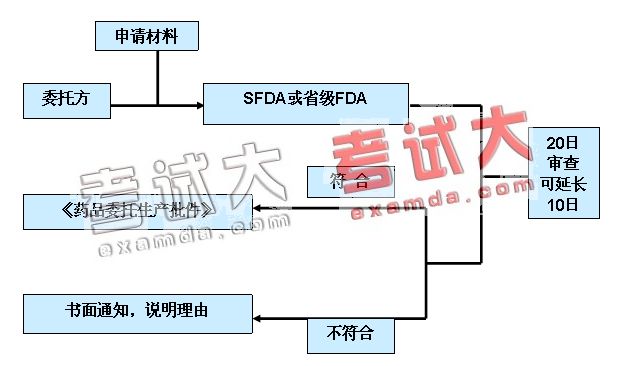
(3)《药品委托生产批件》
有效期不得超过2年,且不得超过该药品批准证明文件规定的有效期限。
有效期届满需要继续委托生产的,委托方应当在有效期届满30日前,按照本办法规定提交有关材料,办理延期手续。
委托生产合同终止的,委托方应当及时办理《药品委托生产批件》的注销手续。
4.药品委托生产申请材料项目
(1)委托方和受托方的《药品生产许可证》、营业执照复印件;
(2)受托方《药品生产质量管理规范》认证证书复印件;
(3)委托方对受托方生产和质量保证条件的考核情况;
(4)委托方拟委托生产药品的批准证明文件复印件并附质量标准、生产工艺,包装、标签和使用说明书实样;
(5)委托生产药品拟采用的包装、标签和使用说明书式样及色标;
(6)委托生产合同;

